Allium cepa: Potenciador Natural del Cierre de Heridas y Viabilidad Celular en Películas de O-Carboximetil Quitosano
DOI:
https://doi.org/10.17488/RMIB.46.1.1484Palabras clave:
Allium cepa, O-carboximetil quitosano, ingeniería tisular, cicatrizaciónResumen
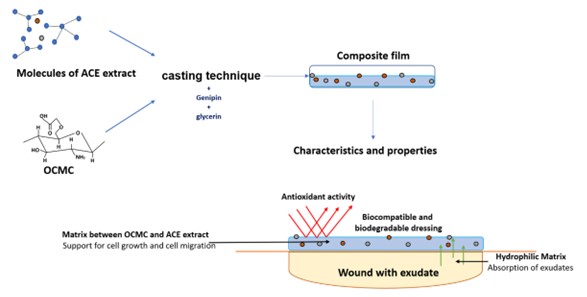
La cicatrización de heridas y el daño en los tejidos son fundamentales para la recuperación del organismo. La medicina regenerativa se ha centrado en desarrollar materiales poliméricos biocompatibles, enriquecidos con principios activos naturales, que posean propiedades cicatrizantes, antiinflamatorias y antimicrobianas. Este estudio tuvo como objetivo mejorar el desempeño de películas de O-carboximetil quitosano utilizando extractos de Allium cepa, una planta endémica de Chihuahua, México. Se analizaron las propiedades del extracto, encontrando un contenido significativo de saponinas, flavonoides y terpenoides, así como una actividad antioxidante del 70 %. La cicatrización in vitro indica que una concentración de 15 mg/mL de extracto de Allium cepa potencia la proliferación y migración celular en fibroblastos. Esta mejora se confirmó en un estudio de viabilidad celular de las películas de O-carboximetil quitosano cargadas con 7 y 20 wt. % mg del extracto, las cuales mostraron un mayor porcentaje de viabilidad celular después de tres días. Los hallazgos sugieren que concentraciones bajas del extracto pueden ser utilizadas como ingredientes activos en biomateriales poliméricos, contribuyendo así a la cicatrización de la piel.
Descargas
Citas
L.-E. Valencia-Gómez, et al., “Characterization and evaluation of a novel O-carboxymethyl chitosan films with Mimosa tenuiflora extract for skin regeneration and wound healing,” J. Bioact. Compat. Polym., vol. 35, no. 1, pp. 39-56, 2020, doi: https://doi.org/10.1177/0883911519885976
L. E. Valencia-Gómez, et al., “Comparative Study of the Antibacterial, Biodegradable, and Biocompatibility Properties of Composite and Bi-Layer Films of Chitosan/Gelatin Coated with Silver Particles,” Materials, vol. 16, no. 8, 2023, art. no. 3000, doi: https://doi.org/10.3390/ma16083000
X.-G. Chen, Z. Wang, W.-S. Liu, H.-J. Park, “The effect of carboxymethyl-chitosan on proliferation and collagen secretion for normal and keloid skin fibroblasts,” Biomaterials, vol. 23, no. 23, pp. 4609-4614, 2002, doi: https://doi.org/10.1016/S0142-9612(02)00207-7
L. Weng, A. Romanov, J. Rooney, W. Chen, “Non-cytotoxic, in situ fellable hydrogels composed of N-carboxymethyl chitin and carboxymethyl chitosan films for potential use in wound care application,” Biomaterials, vol. 29, no. 29, pp. 3905-3913, 2008, doi: https://doi.org/10.1016/j.biomaterials.2008.06.025
S. Sanyal, P. K. Vemula, S. Law, “Investigating the therapeutic potential of Allium cepa extract in combating pesticide exposure induced ocular damage,” Exp. Eye Res., vol. 42, 2024, art. no. 109816, doi: https://doi.org/10.1016/j.exer.2024.109816
H.-S. Lee, et al., “Anti-inflammatory effects of Allium cepa L. peel extracts via inhibition of JAK-STAT pathway in LPS-stimulated RAW264.7 cells,” J. Ethnopharmacol., vol. 317, 2023, art. no. 116851, doi: https://doi.org/10.1016/j.jep.2023.116851
D. E. Garcia, F. Ojeda, “Evaluación de los principales factores que influyen en la composición fitoquímica de Morus alba (Linn.). I. Análisis cualitativo de metabolitos secundarios,” Pastos y Forrajes, vol. 26, no. 4, pp. 335–343, 2003. [Online]. Available: https://payfo.ihatuey.cu/index.php?journal=pasto&page=article&op=view&path%5B%5D=814
X. Lu, et al., “Determination of total phenolic content and antioxidant capacity of onion (Allium cepa) and shallot (Allium oschaninii) using infrared spectroscopy,” Food Chem., vol. 129, no. 2, pp. 637-644, 2011, doi: https://doi.org/10.1016/j.foodchem.2011.04.105
P. Sharma, et al., “Green Synthesis of Silver Nanoparticle Capped with Allium cepa and Their Catalytic Reduction of Textile Dyes: An Ecofriendly Approach,” J. Environ. Polym. Degrad., vol. 26, no. 5, pp. 1795-1803, 2017, doi: https://doi.org/10.1007/s10924-017-1081-7
X. Lu, “Determination of Antioxidant Content and Antioxidant Activity in Foods using Infrared Spectroscopy and Chemometrics: A Review,” Crit. Rev. Food. Sci. Nutr., vol. 52, no. 10, pp. 853-875, 2012, doi: https://doi.org/10.1080/10408398.2010.511322
A. Bhattacharya, “High-temperature stress and metabolism of secondary metabolites in plants. Effect of High Temperature on Crop Productivity and Metabolism of Macro Molecules,” in Effect of High Temperature on Crop Productivity and Metabolism of Macro Molecules, Cambrige, United State: Elsevier, 2019, ch. 5, pp. 391-484, doi: https://doi.org/10.1016/B978-0-12-817562-0.00005-7
R. M. Pérez, et al., “Actividad antioxidante de los alcaloides de Bocconia arborea. Estudio sobre seis métodos de análisis,” Ars Pharm., vol. 44, no. 1, pp. 5–21, 2002, doi: https://revistaseug.ugr.es/index.php/ars/article/view/5122
S. Baliyan, et al., “Determination of Antioxidants by DPPH Radical Scavenging Activity and Quantitative Phytochemical Analysis of Ficus religiosa,” Molecules, vol. 27, no. 4, 2022, art. no. 1326, doi: https://doi.org/10.3390/molecules27041326
M.A. Rojas-Yañez, et al., “Composite scaffolds of chitosan/polycaprolactone functionalized with protein of Mytilus californiensis for bone tissue regeneration,” AIMS Mater. Sci., vol. 9, no. 3, pp. 344-358, 2022, doi: https://doi.org/10.3934/matersci.2022021
N. Arrieta-Sandoval, et al., “Effect of Ag2S-BSA nanoparticle size on 3T3 fibroblast cell line cytotoxicity,” J. Nanopart. Res., vol. 22, 2020, art. no. 106, doi: https://doi.org/10.1007/s11051-020-04834-6
A. Areesanan, et al., “Pharmacological in vitro profiling of Buddleja officinalis flower extracts in the context of dry eye disease,” Biomed. Pharmacother., vol. 181, 2024, art. no. 117685, doi: https://doi.org/10.1016/j.biopha.2024.117685
E. Yadav, et al., “Antioxidant and anti-inflammatory properties of Prosopis cineraria based phenolic rich ointment in wound healing,” Biomed. Pharmacother., vol. 108, pp. 1572-1583, 2018, doi: https://doi.org/10.1016/j.biopha.2018.09.180
A. Joshi, V. K. Joshi, D. Pandey, S. Hemalatha, “Systematic investigation of ethanolic extract from Leea macrophylla: implications in wound healing,” J. Ethnopharmacol., vol. 191, pp. 95-106, 2016, doi: http://dx.doi.org/10.1016/j.jep.2016.06.034
G. Hernández-Pasteur, et al., “Evaluación in vitro de la Actividad Cicatrizante y Antibacteriana de Extractos de Buddleja cordata Kunth y Vismia baccifera (L.) Triana & Planch,” Rev. fitotec. mex., vol. 42, no. 2, pp. 93-99, 2019. [Online]. Available: https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-73802019000200093
Y. Cao, et al., “Quercetin inhibits fibroblasts proliferation and reduces surgery-induced epidural fibrosis via the autophagy-mediated PI3K/Akt/mTOR pathway,” Bioengineered, vol. 13, no. 4, pp. 9973-9986, 2022, doi: https://doi.org/10.1080/21655979.2022.2062530
C. Chittasupho, et al., “Effects of Quercetin and Curcumin Combination on Antibacterial, Antioxidant, In Vitro Wound Healing and Migration of Human Dermal Fibroblast Cells,” Int. J. Mol. Sci., vol. 23, no. 1, 2022, art. no. 142, doi: https://doi.org/10.3390/ijms23010142
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Revista Mexicana de Ingenieria Biomedica

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Una vez que el artículo es aceptado para su publicación en la RMIB, se les solicitará al autor principal o de correspondencia que revisen y firman las cartas de cesión de derechos correspondientes para llevar a cabo la autorización para la publicación del artículo. En dicho documento se autoriza a la RMIB a publicar, en cualquier medio sin limitaciones y sin ningún costo. Los autores pueden reutilizar partes del artículo en otros documentos y reproducir parte o la totalidad para su uso personal siempre que se haga referencia bibliográfica al RMIB. No obstante, todo tipo de publicación fuera de las publicaciones académicas del autor correspondiente o para otro tipo de trabajos derivados y publicados necesitaran de un permiso escrito de la RMIB.











